열역학 제 1법칙을 다시 써 보면 다음과 같이 표현할 수 있습니다.
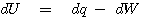
내부에너지 U는 상태함수(state function)이며, closed system에서는 보존됨을 앞에서 살펴 보았습니다.
실재 자연계 내에서 우리가 관측하는 것은 오직 평형상태를 도달하기 위하여 시스템이 변화하는 과정(process)입니다. 따라서 자연현상의 특성(property)을 이해하기 위해서는 평형을 향하는 자발적 과정의 정도(the degree of spontaneity of a process : direction & extent)를 결정하는 표준 특성(criteria)을 이해하는 것이 요구됩니다. 그러나 열역학 제 1법칙의 에너지 이론으로는 이러한 과정을 설명하지 못합니다.
열역학 제 2법칙에서는 이러한 자발적 과정에 대한 내용을 이해할 수 있으며, 상태함수의 존재와 엔트로피(entropy : S)를 결정하게 됩니다. 일반적으로 거시적 열역학 관점에서는 엔트로피를 다음과 같이 정의하게 됩니다.
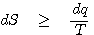
여기서 부등호는 비가역과정을 의미하며, T는 열역학적 온도입니다. 열역학 제 2법칙과 엔트로피를 이해하기 위해서 다음과 같은 순서를 통해서 알아보도록 하겠습니다.
|
카르노 사이클 (Carnot cycle) |
![]()
|
카르노 이론 (Carnot theorem) |
![]()
|
열역학적 온도 (thermodynamic temperature) |
![]()
|
엔트로피 (entropy : S) |
| 복영근(Pock. young-keun) | www.peaceone.net | dreamer@peaceone.net |
<< 아름다운 문화를 만들어 갑시다 ... ^^ >>